Synthetische Herstellung hochmodifizierter messenger RNA
In einer aktuellen Studie beschreibt die Arbeitsgruppe am Institut für Organische Chemie der Universität zu Köln um Professorin Dr. Stephanie Kath-Schorr eine neuartige Methode zur enzymatischen Herstellung von synthetischer messenger RNA (mRNA). Während natürliche Basenmodifikationen von mRNA bereits genutzt werden – etwa von BioNTech/Pfizer zur Herstellung ihres Coronaimpfstoffs – enthält die hier untersuchte mRNA zusätzlich ortsspezifisch eingebrachte, nicht-natürliche Nukleotide. Nukleotide sind Moleküle, die als Grundbausteine der RNA fungieren. Dieser neue Ansatz mit nicht-natürlichen Nukleotiden erlaubt es den Wissenschaftler:innen zu untersuchen, wie mRNA in Zellen eingebracht wird und zu beobachten, wie sie sich die eingebrachten Informationen auf zellulärer Ebene ausbreiten. Dies wiederum verspricht langfristig bessere therapeutische Anwendungen. Der Artikel „Stronger together for in cell translation: natural and unnatural base modified mRNA“ ist im Fachjournal Chemical Science erschienen.
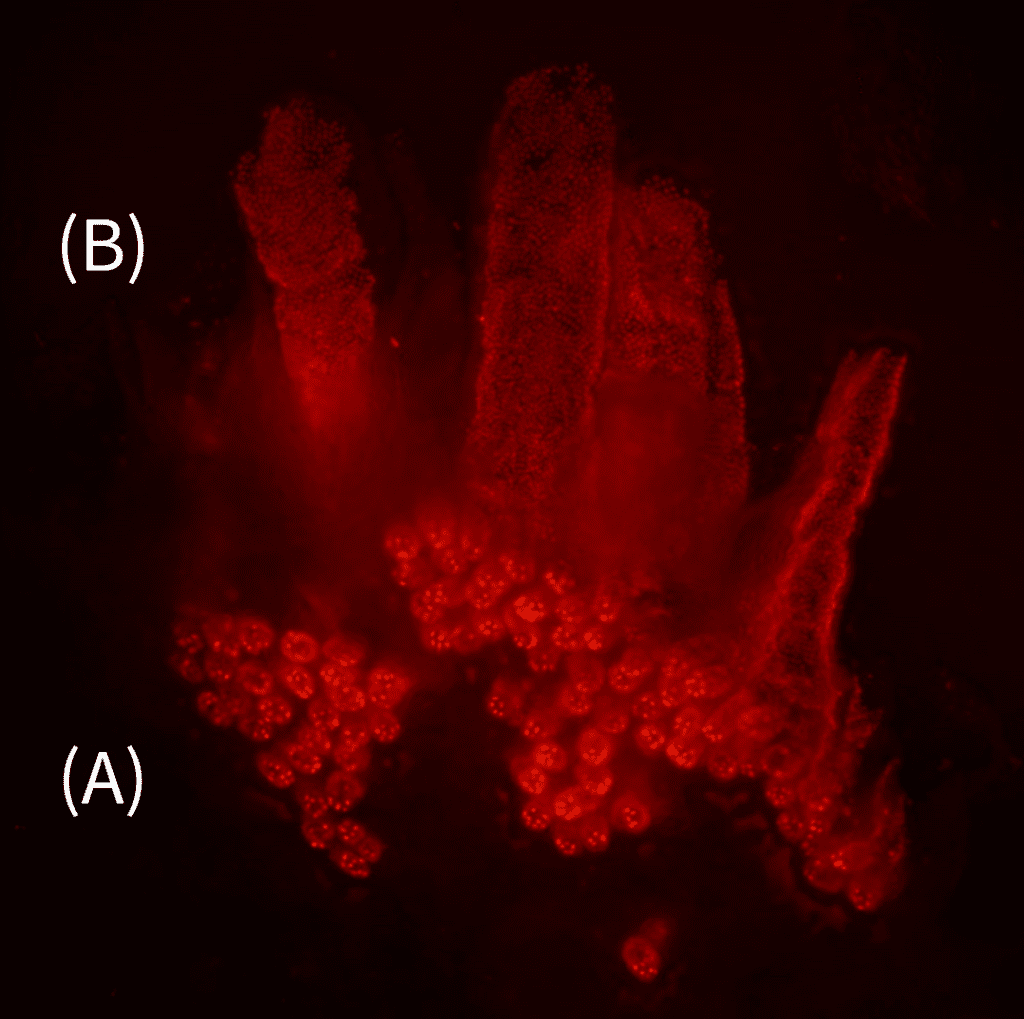
Mit bisherigen Methoden war die Herstellung von mRNAs mit chemisch modifizierten Bausteinen an spezifischen Positionen nicht möglich, da mRNAs aufgrund ihrer Länge von mehreren tausend Bausteinen enzymatisch hergestellt werden. Bei der neuen Methode nutzen die Forscher:innen ein sogenanntes „erweitertes genetisches Alphabet“ während der enzymatischen Abschrift von DNA auf RNA. Wo normalerweise zwei Basenpaare für die Abschrift zuständig sind, schleust das Team ein drittes Basenpaar ein. So können sie gezielt unnatürliche RNA-Nukleotide in Bereiche der mRNA einbringen, die Proteinproduktion modifizieren und die zelluläre Anwendung detailliert untersuchen.
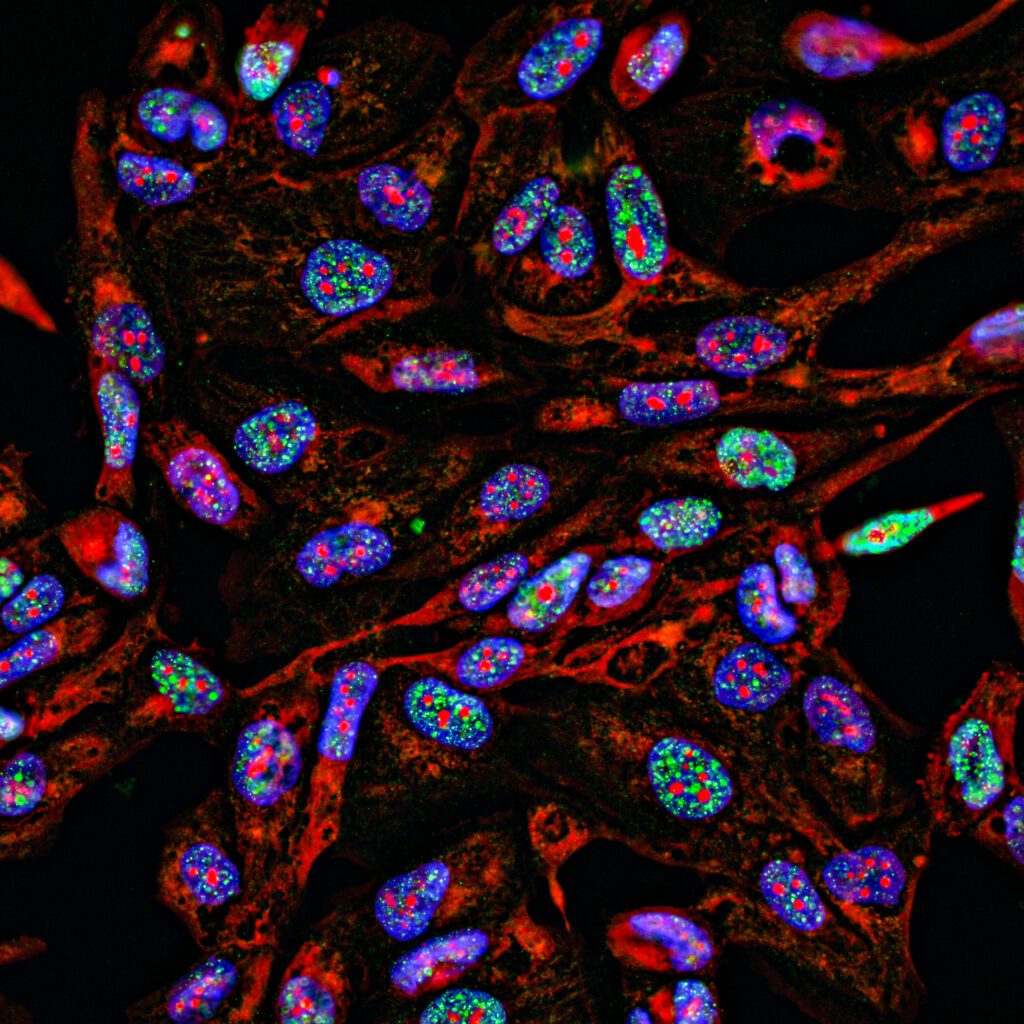
„Wir haben untersucht, wie stabil diese chemisch modifizierte mRNA in Zellen ist, ob sich diese künstlich hergestellte mRNA in Zellen als Matrize für effiziente Proteinproduktion einsetzen lässt und wie der Einfluss der chemischen Modifikationen auf die Proteinproduktion ist“, so Kath-Schorr. Die Ergebnisse zeigen, dass die neue Methode sehr leistungsfähig ist, um die Einschleusung von mRNA in Zellen zu beobachten und die mRNA-Ausbreitung auf zellulärer Ebene sowie die Effizienz der Informationsumschreibung zu überwachen und zu beeinflussen. Dies eröffnet neue Möglichkeiten, effiziente mRNA Therapeutika zu entwickeln – nicht nur als Impfstoffe, sondern auch in der Krebstherapie.
Im Prinzip wäre die Methode auf jedwede mRNA anwendbar. Jedoch müssen dazu noch weitergehende Studien erfolgen, die derzeit in Kooperation mit der Uniklinik Köln in Planung sind. In einem weiteren Schritt müssten langfristig klinische Studien erfolgen. Parallel arbeitet das Team von Kath-Schorr derzeit daran, mRNAs effizienter zu verpacken, um sie in Zelle einzuschleusen. Dabei kooperiert das Institut für Organische Chemie im Rahmen des UoC Forum „Transformative Nanocarriers for RNA Transport and Tracking – Advanced Concepts for Therapy and Diagnostic“ (iRNACarriers) mit Wissenschaftler:innen des Departments für Chemie und der Medizinischen Fakultät.
Quelle: Universität zu Köln